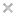|
|||
Готовимся к Новому году (часть 1) |
|||
|
Сегодня – наш первый эксперимент из “новогодней” серии для детей: надуваем воздушные шарики для украшения комнаты. Выполнять это будем с помощью химической реакции соды с уксусом. Выделяющийся в ходе реакции углекислый газ и приводит к надуванию воздушного шара. Данный эксперимент традиционно фигурирует на многих сайтах как опыт, который можно легко выполнять с детьми. Примерный алгоритм его выполнения звучит так: - налейте в пластиковую бутылку раствор соды Между тем, раньше мы уже выполняли подобное (см. статью ”Химический вулкан” ) и убедились, что данная реакция приводит к бурному образованию пены. Как в таких условиях быстро натянуть на горлышко воздушный шарик (когда оттуда активно лезет пена) – непонятно... Кроме того, пока мы в суете надежно зафиксируем шарик, часть газа уже безнадежно потеряется. Чтобы решить данные проблемы, поступим следующим образом: раствор уксуса нальем в бутылку. Часть соды засыпем в сам воздушный шарик. Еще часть соды завернем в бумагу, так что получится своеобразный “пистон”. Диаметр этого “пистона” должен быть чуть меньше диаметра горлышка бутылки – чтобы плотно проходил внутрь. Бумага позволяет растянуть химическую реакцию соды с уксусом во времени, так что не будет происходить бурного образования пены. Наконец, когда с уксусом прореагирует вся сода из “пистона”, будем вытряхивать соду из самого шарика. Таким образом, мы сможем аккуратно провести эксперимент, не потеряв ни грамма углекислого газа. Более подробно все эти нюансы смотрите на видеозаписи. И немного формул напоследок: реакция взаимодействия: Na2CO3 + 2 CH3COOH = 2 CH3COONa + H2CO3 угольная кислота разлагается на CO2 и H2O. Итого, из 2 молей уксуса получается 1 моль углекислого газа. Молярная масса уксуса – 60 г/моль. У нас было примерно 120 г 9%-ного раствора, т.е. это 11 г или 0.18 моля уксуса. Из него получается 0.09 моля углекислого газа или 2 литра. Прямое измерение: диаметр шарика – 15 см, объем такой сферы – 1400 см3 или 1.4 литра. Учитывая “пальцевость” наших расчетов, видим, что цифра довольно близкая. Домашнее задание: |
Рассказать друзьям
| © | права на опубликованные материалы принадлежат их авторам |
Купить научно-популярные книги

Дронова Н. Д., "Секреты ювелирных украшений. Фотографии." |

Стивен Хокинг и Леонард Млодинов, "Кратчайшая история времени" |
Другие статьи этого раздела
Комментарии ( 5 )
-
По размышлениям на чисто бытовом уровне, сок имеет гораздо меньшую кислотность, нежели бытовой раствор уксусной кислоты.0lympian 4 ноября 2010, 10:34
Соответственно, при том же объеме и газа от него должно образовываться меньше. При условии, что не будет недостатка соды и провзаимодействует вся находящаяся в растворе кислота.
Для точных расчетов потребуется процент концентрации лимонной кислоты (C6H8O7) в соке. Этой инфы я, к сожалению, нагуглить не смог. -
Да, если такой шарик лопнет, то праздник будет изрядно подпорчен вонючим запахом и газом, который неблагоприятно влияет на здоровье человека. Способ неплохой, но рискованный. 8 по 10бальной шкале.Rachinskiy Valery 8 апреля 2011, 12:51 -
Но в принципе довольно неплохоRachinskiy Valery 8 апреля 2011, 12:56 
-
Rachinskiy Valery, разве углекислый газ имеет запах? Википедия подсказывает, что нет. У вас же не воняет из бутылки с газировкой, когда вы ее открываете.Administrator 11 апреля 2011, 18:33 -
Простите, я имел ввиду при надувании в присутствии гостей. Углекислый газ не воняет, а вот уксус – да.Rachinskiy Valery 13 апреля 2011, 14:21
Ваш комментарий